
科普 | PCR 问题整理及提高 PCR 扩增特异性的方法总结
先达基因 / 2020-09-24
本文根据自身实验经验总结,针对 PCR 实验过程出现的问题举例,提供可实施的解决方法。并根据经验列举了提高 PCR 反应特异性的方法。
PCR 常见问题分析
问题 1:假阴性(无扩增产物)
现象:正对照有条带,样品无条带
可能原因:
· 模板:含有 Taq 酶抑制剂、杂蛋白,模板上样量低或模板降解
· 引物:引物降解,引物设计不合理
· 试剂:酶失活,buffer 不合适
· 反应条件:退火温度高,延伸时间短
解决方法:
· 纯化模板并重新提取,并检测模板是否含有抑制剂
· 重新设计引物并低温保存
· 优化 buffer,摸索镁离子浓度或适当加入 DMSO(小于 0.3%)
· 提高退火温度,增加延伸时间(反应条件参照试剂盒说明书)
问题 2:假阳性
现象:空白对照出现条带
可能原因:
· 引物设计不适,与目的序列具有同源性
· 试剂污染:水、移液枪等被核酸污染
· 样品间出现交叉污染
解决方法:
· 实验仪器高压灭菌
· 实验试剂(酶除外)高压灭菌,离心管枪头一次性使用
· 规范实验操作
· 假阳性可通过巢式 PCR 解决,或者使用特异性较高的试剂盒扩增
问题 3:拖尾、弥散
现象:电泳出现拖尾、涂抹带
可能原因:
· 酶用量过多
· 模板纯度较低
· dNTP、镁离子浓度过高
· 循环次数过多
解决方法:
· 减少用酶量或使用特异性高的热启动酶扩增
· 纯化模板
· 减少 dNTP 用量,摸索镁离子浓度
· 减少循环次数
问题 4:二聚体及非特异性产物
一般小于 100bp 的条带可基本判断为引物二聚体
主要原因:
· 引物设计不合理,引物自身具有互补性
· 引物浓度不适
· 镁离子浓度过高,退火温度过低
解决方法:
· 重新设计引物并进行 BLAST 检测
· 降低镁离子浓度,提高退火温度
· 增加模板用量

提高 PCR 反应特异性的方法
1. 引物的设计
引物最好在模板 cDNA 的保守区设计,长度 15-30bp,GC 含量小于 60%,3’端不超过连续三个 G 或 C,碱基分
布错落有致,避免引物自身形成二聚体,设计完成之后,需进行 BLAST 检测,如果与其他基因不具有互补性,则可以进行下一步实验。
2. 降落 PCR
降落 PCR 是一种简单的降低非特异性产物的 PCR,最大的优点就是可以降低实验耗时,同时又可以优化实验的步骤。引物的设计决定退火温度,退火温度过高会使 PCR 效率过低,过低则会使非特异扩增过多。这虽然可以通过反复尝试来优化,但费时费力。降落 PCR 提供了一个较为简易的优化方法。首先在较高的温度下扩增,此时虽然扩增效率低,但非特异扩增基本没有。随着退火温度的降低,非特异扩增会逐步增多。但由于此时特异的扩增产物已经达到一定的数量优势,因此会对非特异扩增产生强烈的竞争抑制,从而大幅提高 PCR 的特异性和效率。
3. 热启动扩增
采用热启动方法进行扩增,是除了设计最佳引物之外,提高 PCR 反应特异性最好的方式。在一般的 PCR 反应中,试剂的配置需在冰上进行,且要将 PCR 仪预热,这种方法就类似于热启动,能够一定程度的抑制错配。但是酶在低温下也存在活性,只要体系中有 DNA 链存在,就会扩增产生非特异性条带。采用热启动的方法就是在达到变性温度之前完全抑制酶的活性,而最有效的方法就是使用热启动 Taq 酶(或热启动高保真聚合酶)去扩增,它的原理就是采用化学修饰的方法封闭酶的活性中心,当温度上升到 95℃时恢复活性,指导扩增。
4. 巢式 PCR
采用巢式 PCR 进行扩增,在多轮扩增结果中提高扩增特异性和灵敏度。与普通 PCR 不同的是,它采用两对引物进行扩增,首先用第一对引物普通 PCR,然后将第一轮扩增的产物稀释 100 倍后用第二对引物(巢式引物)二次扩增。因此采用巢式 PCR 可以大大增加困难模板扩增的特异性和有限靶序列的灵敏度。合适的琼脂糖凝胶的浓度
(先达基因 www.gendx.cn)
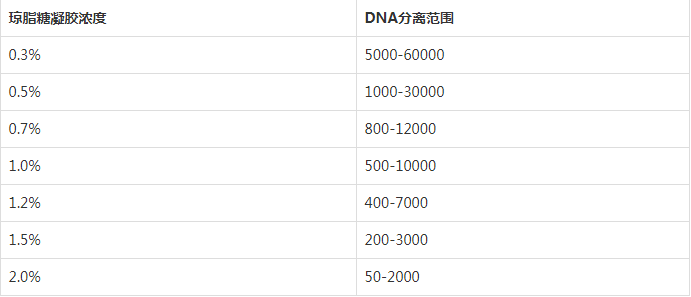
琼脂糖凝胶浓度与 DNA 分离范围
更多阅读
用户评论
(共0条评论)
- 暂时还没有任何用户评论





















