
CRISPR/Cas最新研究进展
先达基因 / 2018-04-16
基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。
刚刚过去的3月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Cell:重磅!发现靶向RNA的CRISPR/CasRx
doi:10.1016/j.cell.2018.02.033

在人细胞的细胞核(灰色)中,靶向RNA的CasRx(洋红色),图片来自Salk Institute。
如今,在一项新的研究中,来自美国沙克生物研究所的研究人员构建出一种靶向RNA而不是靶向DNA的新工具,并利用它校正来自一名痴呆症患者的细胞中的蛋白不平衡,从而让它们恢复到健康水平。这种被称作CasRx的新工具为科学家们提供一种强大的方法来开发新的基因疗法和研究基础的生物学功能。相关研究结果于2018年3月15日在线发表在Cell期刊上,论文标题为“Tranome Engineering with RNA-Targeting Type VI-D CRISPR Effectors”。
Hsu团队决定搜索细菌基因组以寻找能够靶向RNA的新型CRISPR酶,然后对它们进行基因改造而用于解决RNA及其产生的蛋白存在的问题。他们开发出一种计算程序,从而在细菌DNA数据库中寻找CRISPR系统的特征信号:特定的重复DNA序列模式。通过这样做,他们发现一种靶向RNA的CRISPR酶家族,他们称之为Cas13d。
Hsu团队意识到就像Cas9家族一样,源自不同细菌种类的Cas13d酶在它们的活性也会有所不同,因此他们进行筛选,以便鉴定出一种可在人细胞中使用的最佳Cas13d版本。他们发现这种最佳版本来自一种肠道细菌:黄化瘤胃球菌(Ruminococcus flavefaciens)XPD3002,这导致他们将它命名为CasRx。
2.CRISPR专利大战正酣,加州大学在欧洲再胜一筹
欧洲专利局(European Patent Office, EPO)将一件关于CRISPR-Cas9应用的专利(EP3241902B1)授予给Emmanuelle Charpentier、美国加州大学和奥地利维也纳大学。Charpentier是CRISPR共同发现者,也是ERS Genomics公司的共同创始人。这件专利具有广泛保护范围的权利要求,涉及利用这种基因编辑技术进行基因调节,并且针对Cas9蛋白的一种改进版本的组成和应用。这种改进版本最常用于调节基因表达,而不是直接编辑遗传密码本身。这件专利涉及这种改进的CRISPR/Cas9技术在细胞环境和非细胞环境中的使用,包括在细菌、植物、动物和来自人类等脊椎动物的细胞中的使用。
这是EPO授予给Charpentier的第二件专利,涉及将这种基因编辑技术用于基因调节。第一件专利(专利号为EP2800811B1,专利申请号为EP13793997.1)是去年5月正式授予的,针对CRISPR在原核生物细胞、真核生物细胞和有机体中的使用。另一方面,美国哈佛大学-麻省理工学院布罗德研究所(Broad Institute of MIT and Harvard,以下称布罗德研究所)在欧洲的运气较差---在今年1月,EPO撤销了一件属于该研究机构的基础专利(EP2771468B1),这是因为EPO要求该研究机构证实它的科学家是首次在真核生物中使用CRISPR,但是它并未做到这一点。
ERS Genomics公司首席执行官Eric Rhodes在一份新闻稿中表示,这件最新的专利“解决了CRISPR技术的另一组重要的正在被广泛用于新药研发和其他研究领域中的应用”。“这种形式的CRISPR具有广泛的适应性,这是因为它允许研究人员能够选择性地抑制或激活感兴趣的基因,以便确定它们的功能。它是用来确定基因在疾病中的作用的最新工具,这最终会导致新的治疗应用。”
3.Leukemia:利用CRISPR/Cas9增强癌症免疫疗法的疗效
doi:10.1038/s41375-018-0065-5
去年,美国食品药品管理局(FDA)批准了首批用于癌症治疗的细胞免疫疗法。这些疗法涉及收集患者自身的免疫细胞(被称作T细胞),对它们进行基因改进,从而使得它们靶向攻击特定的血液癌症,比如难以治疗的急性淋巴细胞白血病(ALL)和非霍奇金淋巴瘤(non-Hodgkin lymphoma)。但是迄今为止,如果患者的T细胞本身发生癌变,那么这些T细胞免疫疗法 (被称作CAR-T细胞)就不能使用。即便这些经过改造的T细胞能够杀死癌变的T细胞,但它们也能够相互残杀,这是因为它们彼此非常相似。
如今,在一项新的研究中,来自美国华盛顿大学圣路易斯医学院的研究人员利用CRISPR基因编辑技术对人T细胞进行改造,从而使得这些T细胞能够攻击人T细胞癌,而不会自相残杀。相关研究结果于2018年2月20日在线发表在Leukemia期刊上,论文标题为“An “off-the-shelf” fratricide-resistant CAR-T for the treatment of T cell hematologic malignancies”。
DiPersio团队首先开发出一种新的靶向CD7的CAR-T细胞策略,从而允许靶向杀死表面上具有CD7的所有细胞。但是,如果对患者的T细胞进行编程,使得它们靶向CD7,那么它们会攻击癌变的T细胞并且彼此残杀,因而这会破坏这种疗法。为了阻止这些T细胞自相残杀,这些研究人员利用CRISPR/Cas9基因编辑移除健康T细胞中的CD7,这样它们就不再携带这种靶蛋白。此外,他们也利用这种基因编辑技术同时消除这些治疗性T细胞将健康组织视为外来者的能力。为了做到这一点,他们通过基因手段剔除T细胞受体α亚基。通过这种方法,来自任何正常供者的T细胞都能够加以使用,同时不会产生危及生命的风险,如移植物抗宿主病,即来自供者的T细胞攻击受者的组织,这有时会导致死亡。
这些研究人员证实在接受源自患者的T细胞急性淋巴细胞白血病(T-ALL)细胞移植的小鼠中,这种方法是有效的。接受这些经过基因编辑的靶向CD7的T细胞治疗的小鼠存活了65天,而在接受经过基因编辑的靶向不同蛋白的T细胞治疗的对照组小鼠存活了31天。这些研究人员还没有发现这些接受缺乏T细胞受体α亚基的T细胞治疗的小鼠产生移植物抗宿主病的证据。他们还发现这些治疗性T细胞在初次注射后在血液中存在至少六周,这提示着如果发生癌变的T细胞再次出现,它们能够再次大量产生,从而杀死这些癌变的T细胞。
4.Genome Res:当心!体外转录的CRISPR RNA会触发免疫反应
doi:10.1101/gr.231936.117
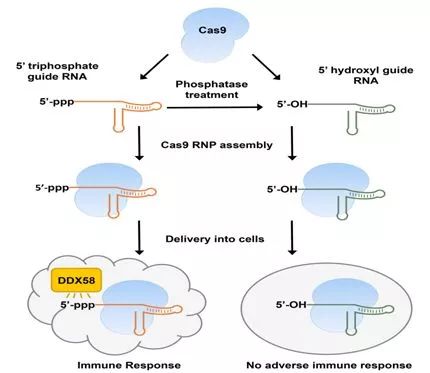
图片来自Sojung Kim。
对许多种有机体而言,CRISPR介导的基因组编辑已成为一种构建疾病模型的强大工具,而且它的临床应用正在开发当中。预先组装的CRISPR-Cas9核糖核蛋白(ribonucleoprotein, RNP)复合物由重组Cas9蛋白和体外转录的向导RNA(gRNA)组成,能够被运送到细胞中,同时不存在将外源DNA整合到宿主基因组中的风险,并且具有较少的脱靶效应。然而,在一项新的研究中,韩国研究人员发现体外转录的gRNA(in vitro transcribed gRNA, IVT gRNA)含有5’ 三磷酸(5'ppp)基团,这会激活人细胞中的免疫反应,从而导致细胞死亡。相关研究结果发表在2018年3月的Genome Research期刊上,论文标题为“CRISPR RNAs trigger innate immune responses in human cells”。
在这项研究中,这些研究人员利用纯化的Cas9与IVT gRNA形成的复合物转染人宫颈癌细胞(HeLa细胞系)和小鼠胚胎成纤维细胞。在这些细胞中,5'ppp gRNA触发I型干扰素介导的免疫反应,以及干扰素激活的抗病毒效应蛋白(如DDX58)的表达增加,从而导致细胞死亡。
此外,这项研究证实了5'ppp gRNA对人T细胞的细胞毒性作用。Kim说,“对T细胞进行基因组编辑在开发治疗癌症和HIV感染的细胞疗法中具有很大的潜力。T细胞对gRNA中的5'ppp基团非常敏感。”T细胞表面受体CCR5参与HIV病毒入侵,因此是开发抵抗HIV感染的疗法的一种有前景的靶标。Kim等人证实利用磷酸酶预先处理IVT gRNA,移除5'ppp基团,这会显著降低T细胞引发的宿主免疫反应和细胞毒性。经过磷酸酶处理的IVT gRNA会增加CCR5的突变效率,从而导致这种HIV辅助受体在细胞表面上的呈递显著下降。
5.NEJM:CRISPR立新功!助力找到导致红细胞增多症的第一个遗传突变!
doi:10.1056/NEJMoa1709064
一个新发现的遗传突变导致了血液中红细胞生成素(erythropoietin,EPO)增多。这个突变导致一个正常情况下并不参与形成该蛋白的信使RNA(mRNA)重编程产生该蛋白质,因此使得血液中的红细胞异常增多。来自巴塞尔大学生物医学系和巴塞尔大学医院的研究人员在《New England Journal of Medicine》上报道了他们的发现。
这个突变事实上会导致EPO基因功能缺失,因为这个碱基的缺失导致了基因编码读码框架发生移动,这意味着不会再形成EPO。尽管如此,病人血液中EPO的含量确实是增加了,并没有降低。
研究人员通过CRISPR技术找到了问题的答案。EPO基因中还有一个隐藏的mRNA,正常情况下并不参与形成EPO。研究人员显示,基因突变也导致这个基因的读码框架发生移动,这就导致了这个基因产生了更多的EPO。
6.Mol Cell:科学家发现弯曲菌中的CRISPR-Cas9系统或能有效切割RNA分子
doi:10.1016/j.molcel.2018.01.032
目前,无论是逆转遗传性疾病,或是改善食品和能源作物的基因编辑技术都正在经历一场革命;这种基因编辑技术是由CRISPR-Cas9所驱动的,CRISPR-Cas9是科学家们在细菌细胞内发现的一种细菌自我防御机制;CRISPR-Cas9能够识别并且切割来自外来病毒的遗传性物质,同时保护细菌免于病毒感染。
Cas9蛋白能够扮演一对剪刀,该系统的其它部分则能够指导Cas9进入DNA部分进行切割,如今研究人员能利用这些“剪刀”分子结合人工引导来特异性地对细菌、植物和动物体内的基因进行修饰;我们都知道Cas9剪刀能够切割DNA,近日,来自德国维尔茨堡大学等机构的研究人员就通过研究发现,食源性致病菌—空肠弯曲菌中的Cas9蛋白或许也能够对RNA分子进行切割,相关研究刊登于国际杂志Molecular Cell上。
当研究者观察与弯曲菌Cas9相互作用的分子时他们发现了Cas9的特殊功能,后期深入分析后研究者发现,Cas9不仅能够绑定到RNA上,还能够对其进行切割,其可以被很容易地进行指挥来切割特定的RNA。本文研究中研究人员从弯曲菌中发现了Cas9蛋白,这或许能够帮助他们更加深入研究Cas9蛋白在自然界中的特性。
7.Nature:强大的xCas9让CRISPR基因编辑更加万能
doi:10.1038/nature26155
图片来自Feng Zhang/Broad Institute。
当沉浸在被称作CRISPR的革命性基因组编辑方法所产生的兴奋中时,你应不会了解到以下一点:正如如今实践中表现的那样,它远非完美。它的标准组分仅在基因组的有限区域中寻找并切割DNA,而且它的分子剪刀会发生摇摆,从而导致“脱靶”突变。许多研究团队正在努力做得更好。如今,在一项新的研究中,由美国哈佛大学化学家David Liu领导的一个团队设计出一种新的CRISPR版本,该版本有潜力变得更加灵巧和更加精确。相关研究结果于2018年2月28日在线发表在Nature期刊上,论文标题为“Evolved Cas9 variants with broad PAM compatibility and high DNA specificity”。
CRISPR有多种形式,但它们都依赖于由RNA组成的向导分子来携带一种DNA切割酶---最为常用的一种是Cas9 ---到基因组的特定区域上。然而,这种复合物在DNA上的着陆位点具有特定的分子特征。标准CRISPR工具包中的酶Cas9因它天然地来源于酿脓链球菌(Streptococcus pyogenes)而被称作spCas9,它仅能够着陆在一端具有特定的三碱基NGG(N代表四种碱基中的任意一种,G代表鸟嘌呤)的基因组片段上。在长32亿个碱基对的人基因组中,大约仅其中的1/16具有正确的序列。Liu说,“这一个真正的限制。”
这项新的研究对spCas9酶进行修饰,从而使得潜在的着陆位点增加了至少4倍。从理论上讲,这可能允许人们破坏或取代CRISPR当前无法触及的与人类疾病相关的基因的许多部分。
Liu实验室先是设计大量稍加改动的spCas9。随后,在64种可能的三碱基着陆位点---在技术上被称为前间隔序列邻近基序(protospacer adjacent motif, PAM)中,Liu团队选择出能够使用更多三碱基着陆位点的spCas9稍加改进版。他们将他们的新酶称为xCas9,最好的xCas9选择着陆位点NGN,这种三碱基存在于四分之一的人基因组中。
用户评论
(共0条评论)
- 暂时还没有任何用户评论





















