
研究 影响IF:5利用ERA扩增技术和CRISPR/Cas12a快速检测ASFV与CaPV病毒的锅式平台
先达基因 / 2024-09-12
背景介绍:非洲猪瘟病毒(ASFV)和山羊痘病毒(CaPV)给畜牧业造成了巨大的经济损失。目前,市场上迫切需要开发一种可靠的检测方法,能快速检测到这两类病毒。此次实验,开发了一种结合ERA技术和CRISPR/Cas12a的ASFV和CaPV的快速快速检测方法,命名为 one-pot-RPA-Cas12a (OpRCas)平台。

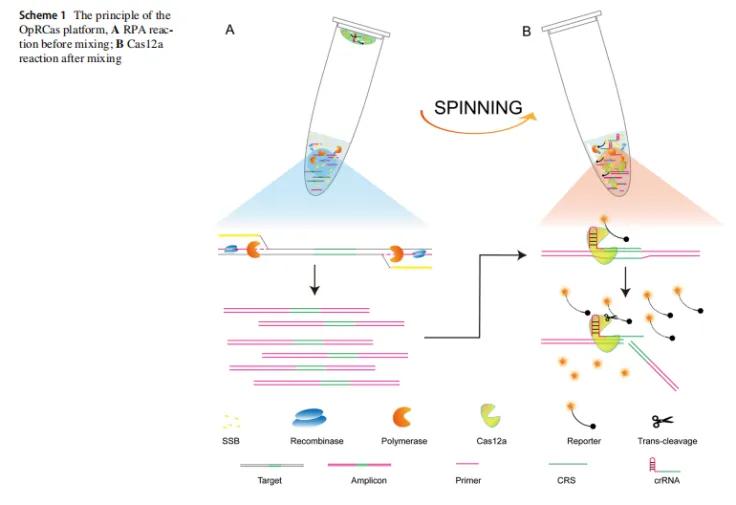
OpRCas作用原理
OpRCas平台基于ERA和CRISPR/ Cas12a,如下图1所示 ,目标基因通过试管底部的ERA扩增数十亿次(图1A ),Cas12a通过与crRNA配对来识别并结合扩增子,激活其顺式裂解和反式裂解活性(图1B)。
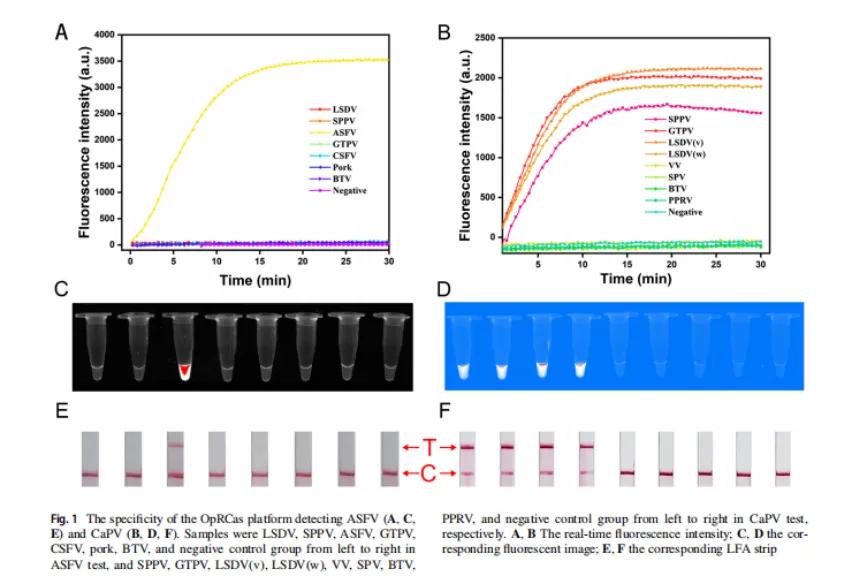
OpRCas检测ASFV和CaPV平台的特异性:
OpRCas平台检测ASFV(A、C、E)和CaPV(B、D、F)的特异性。在ASFV试验中,样本从左至右分别为LSDV、SPPV、ASFV、GTPV、CSFV、猪肉、BTV、阴性对照组;在CaPV试验中,样本从左至右分别为SPPV、GTPV、LSDV (v)、LSDV (w)、VV、SPV、BTV、PPRV、阴性对照组;A、B为实时荧光强度,C、D为对应的荧光图像,E、F对应的LFA条带。
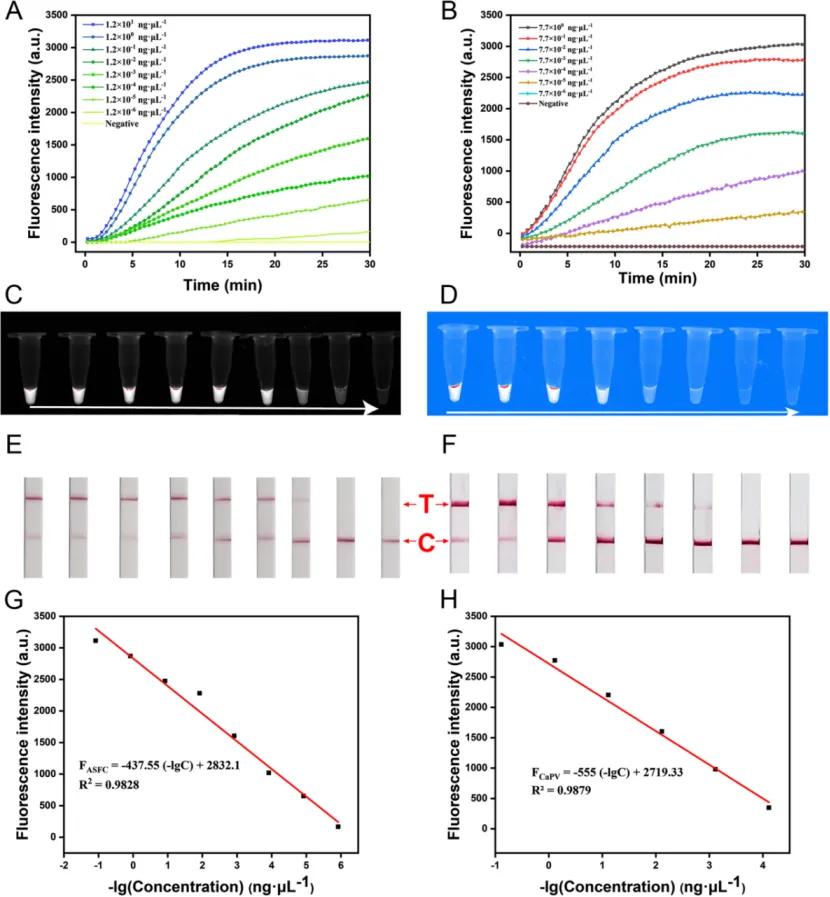
OpRCas平台的灵敏度测试:
OpRCas平台用于检测ASFV(A、C、E、G)和CaPV(B、D、F、H)的灵敏度。ASFV浓度为12ng/µL~1.2×10−6ng/µL,CaPV浓度为7.7ng/µL~7.7×10−6ng/µL。在每组测试结束时都设置了一个阴性对照。A、B、荧光强度;C、D对应的荧光图像;E、F对应的LFA条带。荧光强度与浓度之间的线性关系,FASFV= −437.55×(-lgC)+2832.1 (R2=0.9828)、FCaPV= −555×(-lgC)+2719.33 (R2=0.9879)。
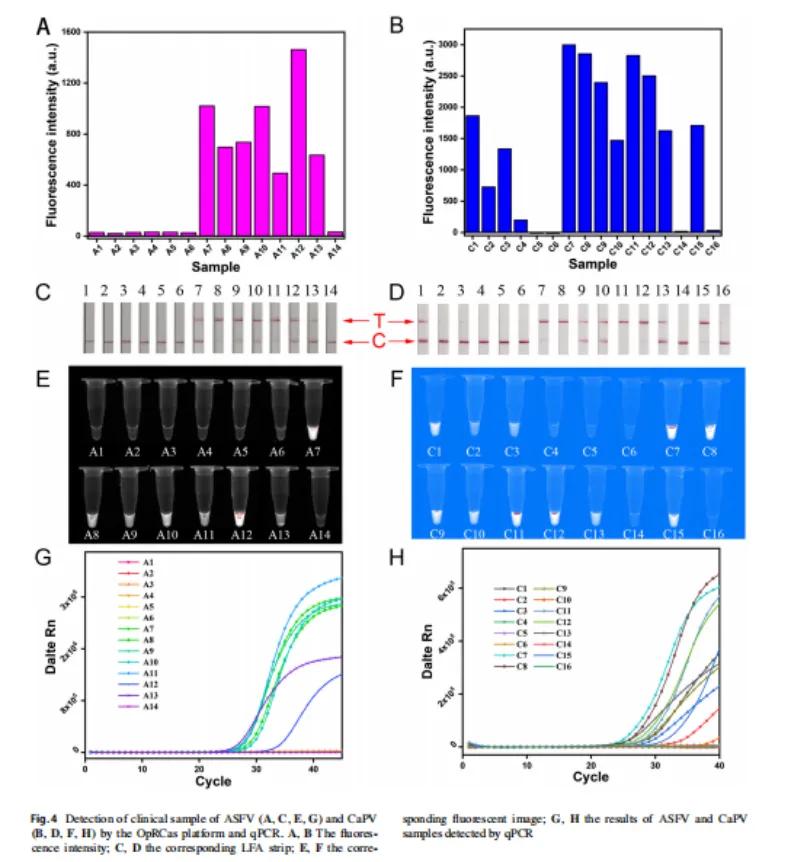
OpRCas平台在临床诊断中的应用:
利用OpRCas平台对14个ASFV样品(A1~A14)和16个CaPV样品(C1~C16)进行了分析。如图4A、E所示,7份样本均为阳性,A7、A8、A9、A10、A11、A12、A13,其余均为阴性。此外,图4C显示了LFA条带的结果。显然,从A7到A13的样品在T线上有明显的条带,而其他样品只在C线上有条带。这些结果与荧光信号相同。为探究检测的准确性,对ASFV样品采用标准方法qPCR进行检测,发现qPCR的结果与图4G中的荧光信号一致。以上数据表明,OpRCas平台检测ASFV的准确率为100%。如图4B、F所示,利用平台检测CaPV样品,发现C1、C2、C3、C7、C8、C9、C10、C11、C13、C15样品荧光较强,C4荧光强度为弱阳性,其他均为阴性。如图4D所示,在LFA条带检测中,大部分结果与阳性样品在T线上有明显的条带,而阴性样品只在C线上有条带,这与荧光检测结果相同。
然而,C4样本显示了不同的结果,即阴性结果。这是因为它的浓度低于该条带的检测极限。在qPCR的验证过程中,C4和C10的结果均为阴性,说明qPCR的敏感性可能不足以准确检测到它们。总体而言,OpRCas平台在检测CaPV相比qPCR检测具有更好的灵敏度。
综上所述,OpRCas是一种临床上稳定可靠的恒温DNA病毒检测技术,在临床应用中比qPCR更方便、更灵敏。
单锅ERA-Cas12a(OpRCas)平台具备ERA技术和CRISPR/Cas12a的优点,如放大率高、恒温反应和严格的目标选择性,使诊断简化、准确、易于操作,无需昂贵的设备。同时,在实验中可一次性将ERA和CRISPR/Cas12a的混合试剂加入到管盖和管底,克服了两种反应的不兼容性和气溶胶污染。为了节省成本,此次实验将常规ERA试剂,控制在每个反应四分之一剂量中,并足以实现临床诊断。





















